灭菌知识
浅谈环氧乙烷灭菌放行
在过去的二十几年,随着监控灭菌过程的系统逐渐完善,以及评价影响微生物灭活的过程参数方法的改进,环氧乙烷灭菌参数放行方式越来越受到广大采用环氧乙烷灭菌的医疗器械生产企业和合同灭菌供应商的重视据统计,医疗器械产品,大约有一半都采用环氧乙烷灭菌。
国内提供环氧乙烷灭菌服务的合同灭菌供应商以及自行灭菌的医疗器械生产企业,绝大多数因设备的限制或对参数放行的认识不足,仍在实施传统的产品放行方式。为此,本文将简单介绍各种方式放行的过程确认、常规控制以及过程有效性维护。希望能通过本文的介绍对合同灭菌供应商以及医疗器械生产企业实施参数放行提供一定的帮助。

环氧乙烷灭菌参数放行的优势
众所周知,采用环氧乙烷灭菌的产品有以下两种放行方式:
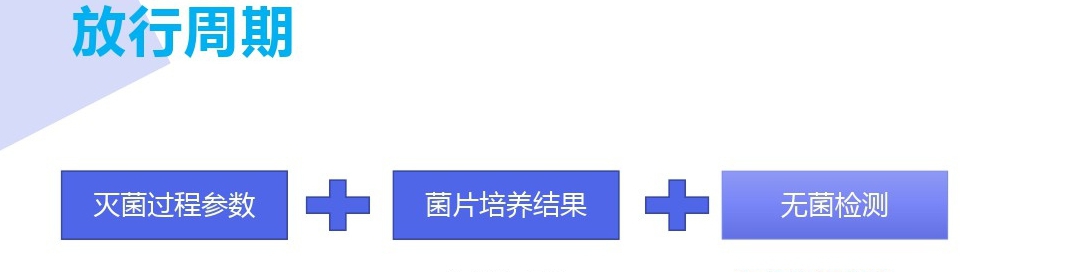
1.传统放行,也就是通常所说的生物指示剂放行。 ISO11135:2014标准要求过程参数必须满足已确认的灭菌过程范围,并且过程中使用的生物指示剂的培养结果显示无菌生长。
参数放行,依据标准中的定义即基于记录证明过程参数在规定的公差范围内申明产品无菌。
两种放行方式相比较,参数放行具有明显的优势
(1)减少库存。依据ISO 11138-1:2017的要求,生物指示剂通常需要7天的培养时间
在常规灭菌处理过程中,采用参数放行无需生物指示剂监控灭菌过程的充分性,这大大缩短了已灭菌产品的放行时间,加快了产品进人市场的速度。
(2)降低成本。对于采用传统放行的灭菌装载,实验室需采购生物指示剂和相应的培养基配置培养基,对培养基灭菌,还需依据相关标准的要求对培养基的生长性能进行测试以证明该批培养基适合微生物的生长,将生物指示剂无菌转移至培养基,按规定要求进行培养。另外,每一装载进行灭菌前,应按已确认的类型和数量要求制备过程挑战装置,用于确定整个灭菌过程是否被充分灭菌,同样,灭菌完成后,这些挑战装置应在规定的时间内从装载上取下用于无菌测试这些均额外增加了人力和物力。常规生产过程中采用参数放行则无需这些步骤。
(3)降低风险。在生物指示剂的培养过程中
若出现生长,需花费大量的人力、物力进行原因调查。即使经过一系列的分析调查,设备、灭菌过程、生物指示剂的储存条件、测试过程等影响因素也未发现有任何异常,且该生长为测试菌即萎缩芽胞杆菌,该灭菌批也必须重新灭菌,合格后方可放行。另外,灭菌结束后,将过程挑战装置从装载取下,又提高了将人员曝露于高浓度环氧乙烷下的风险。参数放行方式则无此风险
当然,并不是所有采用环氧乙烷灭菌的产品均适合参数放行,若产品灭菌后,残留解析时间很长,或者医疗器械生产企业规定,每一灭菌批的产品需进行性能测试或其他检查要求,所需要的时间比生物指示剂培养的时间长,那么实施参数放行的优势则不如其他产品那么明显



